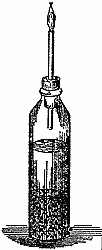|
||||
|
|
ЛЕКЦИЯ III ПРОДУКТЫ ГОРЕНИЯ. ВОДА, ОБРАЗУЮЩАЯСЯ ПРИ ГОРЕНИИ. ПРИРОДА ВОДЫ. СЛОЖНОЕ ВЕЩЕСТВО. ВОДОРОД Надеюсь, вы хорошо помните, что в конце прошлой лекции я использовал выражение "продукты горения свечи". Ведь мы убедились, что когда горит свеча, мы можем при помощи соответствующих приборов получить из нее разнообразные продукты горения. Во-первых, у нас оказался уголь, или копоть, которая не получалась, когда свеча горела хорошо; во-вторых, было какое-то другое вещество, которое имело вид не дыма, а чего-то другого, но составляло часть того общего потока, который, восходя от пламени, становится невидимым и исчезает. Были там также и другие продукты горения, о которых должна была идти речь дальше. Мы ведь, помните, обнаружили, что в составе струи, восходящей от свечи, одну часть можно сконденсировать, поставив на ее пути холодную ложку, чистую тарелку или любой другой холодный предмет, другая же часть не конденсируется. Сперва мы исследуем конденсирующуюся .часть продуктов; как это ни странно, мы найдем, что это всего-навсего вода. Прошлый раз я об этом упомянул мельком - только сказал, что среди поддающихся конденсации продуктов сгорания свечи есть и вода. Сегодня же я хочу привлечь ваше внимание как раз к воде, чтобы вы могли ее тщательно исследовать не только в связи с нашей основной темой, но также и вообще, в связи с вопросом о ее существовании на земном шаре.
Сейчас у меня все готово для опыта по конденсации воды из продуктов горения свечи, и я прежде всего постараюсь доказать вам, что это действительно вода. Пожалуй, лучший способ показать ее присутствие сразу всей аудитории - это продемонстрировать какое-нибудь действие воды, которое было бы ясно видно, а затем испытать таким образом то, что соберется в каплю на дне вот этой чашечки. (Лектор подставляет свечу под чашечку со смесью льда и соли.) Здесь у меня некое вещество, открытое сэром Гэмфри Дэви; оно очень энергично реагирует с водой, и я этим воспользуюсь, чтобы доказать наличие воды. Это калий, добываемый из поташа. Я беру маленький кусочек калия и бросаю его в эту чашку. Вы видите, как он доказывает наличие воды в чашке - калий вспыхивает, горит ярким, сильным пламенем и при этом бегает по поверхности воды. Теперь я уберу свечу, которая некоторое время горела у нас под чашечкой со смесью льда и соли; вы видите, что со дна чашечки свисает капля воды - сконденсированного продукта горения свечи. Я покажу вам, что калий даст с этой водой такую же реакцию, как с водой в чашке. Смотрите... Калий вспыхивает и горит совершенно так же, как в предыдущем опыте. Другую каплю воды я улавливаю на это стекло, кладу на нее кусочек калия, и по тому, как он загорается, вы можете судить о том, что здесь присутствует именно вода. А вы помните, что эта вода возникла из свечи. Точно так же, если я накрою вот той банкой зажженную спиртовку, вы скоро увидите, как банка запотеет от осаждающейся на ней росы, а эта роса опять-таки есть результат горения. По каплям, которые будут капать на подостланную бумагу, вы, без сомнения, через некоторое время увидите, что от горения спиртовки получается изрядное количество воды. Я не буду сдвигать эту банку, и вы потом сможете посмотреть, сколько воды накопится. Подобным же образом, поместив охлаждающее устройство над газовой горелкой, я также получу воду, потому что вода образуется и при горении газа. В этой банке собрано некоторое количество воды - идеально чистой, дистиллированной воды, полученной при горении светильного газа; она ничем не отличается от воды, какую вы могли бы добыть путем перегонки из речной, океанской или ключевой - это в точности такая же вода. Вода - химический индивид, она всегда одинакова. Мы можем подмешать к ней посторонние вещества или удалить из нее содержащиеся в ней примеси; однако вода как таковая остается всегда собой - твердой, жидкой или газообразной. Вот здесь (лектор показывает другой сосуд) вода, полученная при горении масляной лампы. Из масла, если его надлежащим образом сжигать, можно получить даже несколько большее по объему количество воды. А вот здесь вода, добытая из восковой свечи путем довольно длительного опыта. И так мы можем перебрать одно за другим почти все горючие вещества и убедиться, что если они, как свеча, дают пламя, то при их сгорании получается вода. Такие опыты вы можете проделать сами. Для начала очень хороша рукоятка кочерги[ 17 ], если ее удастся достаточно долго продержать над пламенем свечи так, чтобы она оставалась холодной, вы сможете добиться, чтобы на ней каплями осела вода. Для этого годится и ложка, и поварешка, и вообще любой предмет, лишь бы он был чистым и обладал достаточной теплопроводностью, т.е. чтобы он мог отводить тепло и, таким образом, конденсировать пары воды. Теперь, если уж вдаваться в то, как происходит это удивительное выделение воды из горючих материалов в процессе их горения, я должен прежде всего рассказать, что вода может существовать в различных состояниях. Правда, вы уже знакомы со всеми видоизменениями воды, но тем не менее нам сейчас необходимо уделить им некоторое внимание для того, чтобы мы могли осознать, каким образом вода, претерпевая, подобно Протею[ 18 ], свои многообразные изменения, остается всегда одним и тем же веществом - все равно, получена ли она из свечи при ее сгорании, или же из рек или океана. Начнем с того, что в наиболее холодном состоянии вода представляет собой лед. Однако мы с вами как естествоиспытатели - ведь я надеюсь, нас с вами можно объединить под этим названием, - говоря о воде, называем ее водой, все равно, находится ли она в твердом, жидком или газообразном состоянии; в химическом смысле это всегда вода. Вода есть соединение двух веществ, одно из которых мы получали из свечи, а второе нам предстоит найти вне ее. Вода может встречаться в виде льда, и за последнее время вы имели прекрасную возможность убедиться в этом. Лед превращается обратно в воду при повышении температуры. В прошлое воскресенье мы видели яркий пример этого превращения, которое привело к печальным, последствиям в некоторых наших домах.[ 19 ] Вода в свою. очередь превращается в пар, если ее достаточно нагреть. Та вода, которую вы видите здесь перед собой, обладает наибольшей плотностью[ 20 ], и хотя она меняется по весу, по состоянию, по форме и многим другим свойствам, она продолжает оставаться водой. При этом, будем ли мы превращать ее в лед путем охлаждения или же в пар путем нагревания, вода по-разному увеличивается в объеме: в первом случае - очень незначительно и с большой силой, а во втором - изменение объема велико.
Например, я беру этот тонкостенный жестяной цилиндр и наливаю в него немножко воды. Вы видели, как мало я налил, и можете без труда самостоятельно сообразить, какова будет высота воды в этом сосуде: вода покроет дно слоем приблизительно в два дюйма. Теперь я собираюсь превратить эту воду в пар, чтобы показать вам разницу в объеме, занимаемом водой в ее различных состояниях - воды и пара. Пока разберем, что происходит при превращении воды в лед. Это можно осуществить, охлаждая ее в смеси толченого льда с солью[ 21 ], и я это проделаю, чтобы показать вам расширение воды при этом превращении в нечто, обладающее большим объемом. Вот эти чугунные бутылки (показывает одну из них) очень прочные и очень толстостенные - их толщина примерно треть дюйма. Их очень аккуратно наполнили водой, не оставив в них ни пузырька воздуха, и затем плотно завинтили. Когда мы заморозим воду в этих чугунных сосудах, мы увидим, что они не смогут вместить получившийся лед. Происходящее внутри них расширение разорвет их на куски. Вот это - обломки точно таких же бутылок. Наши две бутылки я кладу в смесь льда и соли, и вы убедитесь, что при замерзании вода изменяется в объеме с такой большой силой. А теперь давайте посмотрим на изменения, происшедшие с той водой, которую мы поставили кипятиться; она, оказывается, перестает быть жидкостью. Об этом можно судить по следующим обстоятельствам. Я прикрыл часовым стеклом горлышко колбы, в которой сейчас кипит вода. Видите, что происходит? Стеклышко вовсю стучит, как будто клапан в машине, потому что пар, поднимающийся от кипящей воды, с силой вырывается наружу и заставляет этот "клапан" подпрыгивать. Вы без труда можете сообразить, что колба целиком заполнена паром - ведь иначе он не стал бы прокладывать себе дорогу силой. Вы видите также, что в колбе содержится какое-то вещество, значительно большее по объему, чем вода, - ведь оно не только наполняет всю колбу, но, как видите, и улетает в воздух. Однако вы не наблюдаете существенной убыли в количестве оставшейся воды, и это вам показывает, сколь велико изменение объема при превращении воды в пар. Вернемся опять к нашим чугунным бутылкам с водой, которые я положил вот в эту охлаждающую смесь, чтобы вы могли наблюдать, что с ними произойдет. Как вы видите, между водой в бутылках и льдом во внешнем сосуде сообщения нет. Но между ними происходит перенос тепла, так что если опыт удастся (ведь мы его проводим в очень большой спешке), вы через некоторое время, как только холод завладеет бутылками и их содержимым, услышите взрыв: это лопнет какая-нибудь из бутылок. И, осмотрев затем бутылки, мы обнаружим, что их содержимое представляет собой куски льда, частично покрытые чугунной скорлупой, которая оказалась для них слишком тесной, потому что лед занимает больше места, чем вода, из которой он получился. Вы прекрасно знаете, что лед на воде плавает; если зимой под мальчиком подламывается лед и он проваливается в воду, он пытается выкарабкаться на льдину, которая его "поддержит. Почему же лед плавает? Подумайте, и вы, наверно, найдете объяснение: лед по объему больше, чем та вода, из которой он получается; поэтому лед легче, а вода тяжелее. Вернемся теперь к действию тепла на воду. Посмотрите, какая струя пара выходит из этого жестяного цилиндра! Очевидно, пар его целиком заполняет, раз он оттуда так валит. Но если посредством тепла мы можем превращать воду в пар, то посредством холода мы можем вернуть пар в состояние жидкости. Возьмем стакан или любой другой холодный предмет и подержим его над этой струей пара - смотрите, как он быстро запотевает! Пока стакан не согреется, он будет продолжать конденсировать пар в воду - вот она уже стекает по его стенкам. Я покажу вам еще один опыт с конденсацией воды из парообразного состояния обратно в жидкое. Вы уже видели, что один из продуктов горения свечи - водяной пар. Мы получали его в жидком виде, заставляя оседать на дне чашечки с охлаждающей смесью. Чтобы показать вам неизбежность таких переходов, я завинчу горлышко этого жестяного цилиндра, который теперь, как вы видели, наполнен паром. Посмотрим, что произойдет, когда мы охладим цилиндр снаружи и этим заставим водяной пар вернуться в жидкое состояние. (Лектор обливает цилиндр холодной водой, и тотчас же его стенки вдавливаются внутрь.) Вот видите, что получилось. Если бы я, завинтив горлышко, продолжал нагревать цилиндр, его бы разорвало давлением пара, а когда пар возвращается в жидкое состояние, цилиндр оказывается смятым, так как внутри него образуется пустота в результате конденсации пара. Сосуд вынужден уступить, его стенки вдавливаются внутрь; наоборот, если бы завинченный цилиндр с паром нагревался дальше, их бы разорвало изнутри. Эти опыты я вам показываю для того, чтобы обратить ваше внимание на то, что во всех этих случаях нет превращения воды в какое-нибудь другое вещество: она продолжает оставаться водой.
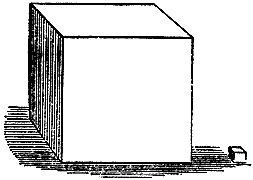
А как вы себе представляете, насколько увеличивается объем воды, когда она переходит в газообразное состояние? Взгляните на этот куб (показывает кубический фут), а вот рядом с ним кубический дюйм[ 22 ]. Форма у них одинаковая, и различаются они только по объему. Так вот, одного кубического дюйма воды оказывается достаточно для того, чтобы расшириться до целого кубического фута пара. И наоборот, от действия холода это большое количество пара сожмется до такого маленького количества воды... (В этот момент лопается одна из чугунных бутылок.) Ага! Вот взорвалась одна из наших бутылок, - смотрите, вдоль нее идет трещина шириной в восьмую дюйма. (Тут разрывается другая бутылка, и охлаждающая смесь разлетается во все стороны.) Вот и вторая бутылка лопнула; ее разорвало льдом, хотя чугунные стенки были почти в полдюйма толщиной. Такого рода изменения происходят с водой всегда; не думайте, что их обязательно надо вызывать искусственным путем. Это только сейчас нам пришлось воспользоваться такими средствами, чтобы ненадолго устроить около этих бутылок зиму в малом масштабе вместо настоящей длинной и суровой зимы. Но если вы побываете в Канаде или на Крайнем Севере, вы убедитесь, что там наружная температура достаточна, чтобы произвести на воду тот же эффект, какого мы здесь добивались нашей охлаждающей смесью. Однако вернемся к нашим рассуждениям. Стало быть, никакие изменения, происходящие с водой, не смогут теперь ввести нас в заблуждение. Вода - везде одна и та же вода, получена ли она из океана или из пламени свечи. Где же, в таком случае, находится та вода, которую мы получаем из свечи? Чтобы ответить на этот вопрос, я должен буду немного забежать вперед. Совершенно очевидно, что эта вода частично появляется из свечи, - но была ли она в свече прежде? Нет, воды не было ни в свече, ни в окружающем воздухе, необходимом для горения свечи. Вода возникает при их взаимодействии: одна составная часть ее берется из свечи, другая - из воздуха. Именно это мы должны теперь проследить, чтобы до конца понять, каковы химические процессы, происходящие в свече, когда она горит перед нами на столе. Как же мы до этого доберемся? Мне-то известно множество путей, но я хочу, чтобы вы додумались сами, размышляя над тем, что я вам уже сообщил. Думаю, что кое-что вы сможете сообразить вот как. В начале сегодняшней лекции мы имели дело с неким веществом, своеобразную реакцию которого с водой открыл сэр Гэмфри Дэви.[ 23 ] Я напомню вам эту реакцию, повторив еще раз опыт с калием. С этим веществом надо обращаться очень осторожно: ведь если у нас на кусок калия попадет хоть капля воды, это место сейчас же загорится, а от него, при условии свободного доступа воздуха, живо загорелся бы и весь кусок. Так вот, калий - это металл с прекрасным ярким блеском, быстро изменяющийся на воздухе и, как вы знаете, в воде. Я опять кладу кусочек калия на воду, - видите, как он чудесно горит, образуя как бы плавучий светильник и используя для горения вместо воздуха воду. Положим теперь в воду немного железных опилок или стружек. Мы обнаружим, что они также претерпевают изменения. Меняются они не так сильно, как этот калий, но до некоторой степени схожим образом: они ржавеют и воздействуют на воду, хотя и не столь интенсивно, как этот чудесный металл, но, в общем, их реакция с водой носит тот же характер, что и реакция калия. Сопоставьте мысленно эти различные факты. Вот еще один металл - цинк; вы имели случай убедиться в его способности гореть, когда я вам показывал, что при его сгорании получается твердое вещество. Я полагаю, что если сейчас взять узкую стружку цинка и подержать ее над пламенем свечи, то вы увидите явление, так сказать, промежуточное между горением калия на воде и реакцией железа - произойдет горение особого рода. Вот цинк сгорел, оставив белую золу. Итак, мы видим, что металлы горят и действуют на воду. Шаг за шагом мы научились управлять действием этих различных веществ и заставлять их рассказывать нам о себе. Начнем с железа. У всех химических реакций есть общая черта: они от нагревания усиливаются. Поэтому нам часто приходится применять тепло, если надо детально и внимательно исследовать взаимодействие тел. Вам, надо полагать, уже известно, что железные опилки прекрасно горят в воздухе, но я все же покажу это вам сейчас на опыте, чтобы вы твердо усвоили то, что я вам собираюсь рассказать о действии железа на воду. Возьмем горелку и сделаем ее пламя полым - вы уже знаете, для чего: я хочу подвести воздух к пламени и изнутри. Затем возьмем щепотку железных опилок и будем бросать их в пламя. Видите, как они хорошо горят. Это и есть химическая реакция, которая происходит, когда мы поджигаем эти частицы железа. Теперь разберем эти различные виды взаимодействия и выясним, что станет делать железо, когда оно встретится с водой. Все это оно само нам расскажет, и притом так занимательно и систематично, что, я уверен, вы получите большое удовольствие.
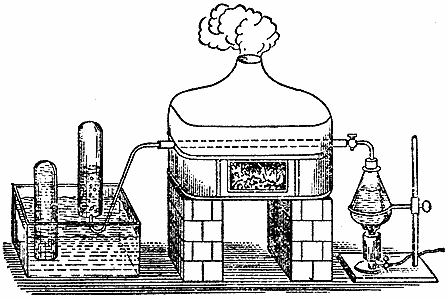
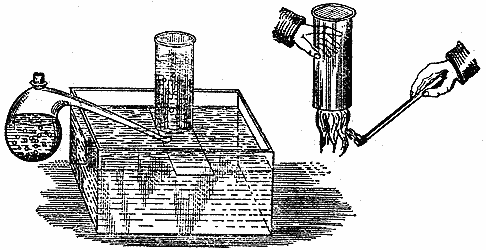
Вот тут у меня печь с проходящей сквозь нее железной трубкой вроде ружейного ствола. Эту трубку я набил блестящими железными стружками и поместил ее над огнем, чтобы она раскалилась докрасна. Сквозь эту трубку мы можем пропускать либо воздух, чтобы он приходил в соприкосновение с железом, либо пар из этого маленького кипятильника, присоединив его к концу трубки. Вот кран, который закрывает водяному пару доступ в трубку, пока нам не понадобится его туда впустить. В этих сосудах - вода, которую я подсинил, чтобы вам виднее было, что произойдет. Вы уже прекрасно знаете, что если из этой трубки будет выходить именно водяной пар, то он при пропускании через воду обязательно сгустится; ведь вы же убедились, что пар, будучи охлажден, не может остаться в газообразном состоянии; в нашем опыте с этим жестяным цилиндром вы видели, как пар сжался в небольшой объем, и в результате оказался исковерканным цилиндр, в котором находился пар. Таким образом, если бы я стал пропускать пар сквозь эту трубку, и притом она была бы холодная, пар сгустился бы в воду; вот почему трубку раскаляют для проведения того опыта, который я сейчас собираюсь показать вам. Впускать пар в трубку я буду небольшими порциями, и когда вы увидите его выходящим из другого конца трубки, вы сможете сами судить, продолжает ли он оставаться паром. Итак, пар обязательно превращается в воду, если понижать его температуру. Но этот газ, который поступает из раскаленной трубки и температуру которого я понизил, пропуская его сквозь воду, собирается в банке и не превращается в воду. Подвергну этот газ другому испытанию. (Банку приходится держать опрокинутой, иначе наше вещество из нее улетучится.) Я подношу огонек к отверстию банки, газ с легким шумом загорается. Отсюда понятно, что это не водяной пар - ведь пар тушит огонь, а гореть не может, - здесь же вы только что видели, что содержимое банки горело. Добыть это вещество можно как из воды, получающейся в пламени свечи, так и из воды любого другого происхождения. Когда этот газ получается в результате действия железа на водяной пар, железо приходит в состояние, весьма сходное с тем, в каком оказались эти железные опилки, когда они сгорели. Эта реакция делает железо более тяжелым, чем оно было раньше. В том случае, если железо, оставаясь в трубке, подвергается накаливанию и снова остывает без доступа воздуха или воды, его масса не меняется. Но когда сквозь эти железные стружки мы пропустили струю водяного пара, железо оказалось тяжелее, чем прежде: оно присоединило к себе нечто из пара и пропустило мимо себя нечто другое, что мы и видим вот в этой банке. А теперь, раз у нас есть еще полная банка этого газа, я покажу вам очень интересную вещь. Газ этот - горючий, так что я мог бы сразу поджечь содержимое этой банки и доказать вам его горючесть; но я намерен показать вам и еще кое-что, если мне удастся. Дело в том, что полученное нами вещество очень легкое. Водяному пару свойственно конденсироваться, а это вещество не конденсируется, и ему свойственно уноситься в воздух. Возьмем другую банку, пустую, т. е. в которой нет ничего, кроме воздуха; исследуя ее содержимое зажженной лучинкой, можно убедиться, что в ней действительно ничего другого нет.
Теперь я возьму банку, полную добытого нами газа, и буду обращаться с ним, как с легким веществом: держа обе банки опрокинутыми, я подведу одну под другую и переверну. Что же теперь содержится в той банке, где был газ, добытый из пара? Вы можете убедиться, что теперь там только воздух. А тут? Смотрите, тут находится горючее вещество, которое я таким образом перелил из той банки в эту. Газ сохранил свое качество, состояние и особенности - тем более он заслуживает нашего рассмотрения, поскольку он получен из свечи.
Это же вещество, которое мы только что добыли путем воздействия железа на пар или воду, можно получить и при помощи тех других веществ, которые, как вы уже видели, так энергично действуют на воду. Если взять кусочек калия, то, устроив все как следует, можно получить этот самый газ. Если же вместо калия взять кусочек цинка, то, исследовав его весьма тщательно, мы найдем, что основная причина, почему цинк не может подобно калию длительно действовать на воду, сводится к тому, что под действием воды цинк покрывается своего рода защитным слоем. Иначе говоря, если мы поместим в наш сосуд только цинк и воду, они сами по себе не вступят во взаимодействие и результатов мы не получим. А что, если я смою растворением защитный слой, т.е. мешающее нам вещество? Для этого мне нужно немножко кислоты; и как только я это проделаю, я увижу, что цинк действует на воду точно так же, как железо, но при обычной температуре. Кислота не изменяется вовсе, за исключением того, что она соединяется с получающейся окисью цинка. Вот я наливаю немного кислоты в сосуд - результат такой, как будто она кипит ключом.
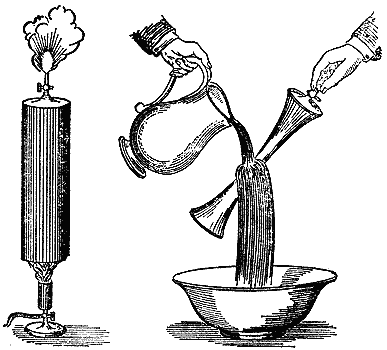
От цинка отделяется в большом количестве что-то такое, что не является водяным паром. Вот полная банка этого газа. Вы можете убедиться, что, пока я держу банку опрокинутой вверх дном, в ней остается как раз то же самое горючее вещество, какое я добывал в опыте с железной трубкой. То, что мы получаем из воды, - это то же вещество, которое содержится в свече. Теперь давайте четко проследим связь между этими двумя фактами. Этот газ - водород, вещество, принадлежащее к тем, которые мы называем химическими элементами, потому что их нельзя разложить на составные части. Свеча - тело не элементарное, так как из нее мы можем получить углерод, а также и водород, - из нее или, по крайней мере, из той воды, которую она выделяет. Этот газ и назван водородом потому, что это элемент, который, в сочетании с другим элементом, порождает воду. Мистер Андерсон уже успел получить несколько банок этого газа. Нам предстоит проделать с ним некоторые опыты, и я хочу показать вам, как их лучше всего делать. Я не боюсь вас этому научить: ведь я хочу, чтобы вы сами занимались опытами, но при том непременном условии, чтобы вы их проделывали внимательно и осторожно и с согласия ваших домашних. По мере того, как мы продвигаемся в изучении химии, нам приходится иметь дело с веществами, которые могут оказаться довольно вредными, если попадут не туда, куда надо. Так, кислоты, огонь и горючие вещества, которые мы здесь применяем, могли бы причинить вред, если ими пользоваться неосторожно. Если вы захотите добывать водород, вы легко можете получить его, заливая кусочки цинка кислотой - серной или соляной. Вот посмотрите на то, что в прежние времена называлось "философской свечой": это бутылочка с пробкой, через которую проходит трубка. Я кладу в нее несколько мелких кусочков цинка. Этот приборчик послужит нам сейчас на пользу, так как я хочу показать вам, что вы у себя дома можете добывать водород и проделать с ним кое-какие опыты по собственному желанию. Сейчас я вас объясню, почему я так аккуратно наливаю эту бутылочку почти дополна, но все-таки не совсем. Эта предосторожность вызывается тем, что получающийся газ (который, как вы видели, очень горюч) оказывается чрезвычайно взрывчатым в смеси с воздухом и мог бы наделать бед, если бы вы поднесли огонь к концу этой трубочки, прежде чем весь воздух будет изгнан из оставшегося над водой пространства. Волью туда серную кислоту. Я взял очень мало цинка, а больше серной кислоты с водой, так как мне нужно, чтобы наш приборчик работал в течение некоторого времени. Поэтому я нарочно так и подбираю соотношение составных частей, чтобы газ вырабатывался в надлежащем количестве - не слишком быстрой не слишком медленно.
Возьмем теперь стакан и подержим его вверх дном над концом трубки; я рассчитываю, что водород благодаря своей легкости некоторое время не улетучится из этого стакана. Сейчас мы проверим содержимое стакана - есть ли в нем водород. Думаю, что я не ошибусь, сказав, что мы уже его уловили. (Лектор подносит к банке с водородом горящую лучинку.) Ну, вот видите, так и есть. Теперь я поднесу лучинку к концу трубки. Вот водород и горит, вот наша "философская свеча". Вы можете сказать, что ее пламя слабое, никудышное, но оно такое горячее, что вряд ли какое-нибудь обыкновенное пламя даст столько же тепла. Оно продолжает ровно гореть, и теперь я поставлю прибор так, чтобы мы могли исследовать то, что из этого пламени получится, и использовать добытые таким образом сведения, Поскольку свеча производит воду, а этот газ получается из воды, посмотрим, что он нам даст при сгорании, т.е. в том самом процессе, который претерпевала свеча, когда она горела в воздухе. Для этой цели я ставлю нашу склянку вот под этот аппарат, чтобы иметь возможность сконденсировать в нем все, что только сможет возникнуть от горения. Через короткое время вы увидите, как в этом цилиндре появится туман и по стенкам начнет стекать вода. Полученная из водородного пламени вода будет во всех испытаниях вести себя совершенно так же, как вода, полученная ранее: ведь общий принцип ее получения одинаков.
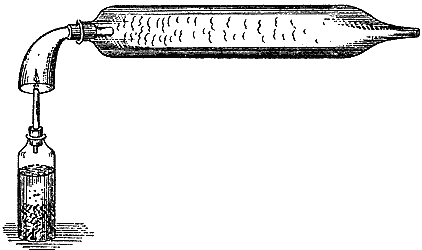
Водород -- интереснейшее вещество. Он такой легкий, что способен уносить предметы вверх; он гораздо легче воздуха, и я, пожалуй, смогу вам это показать на таком опыте, который кому-нибудь из вас, может быть, и удастся повторить, если вы наловчитесь. Вот наша банка - источник водорода, а вот мыльная вода. К банке я присоединяю резиновую трубку, на другом конце которой приспособлена курительная трубка. Опуская ее в мыльную воду, я могу выдувать мыльные пузыри, наполненные водородом. Смотрите, когда я надуваю пузыри своим дыханием, они не держатся в воздухе, а падают. Теперь заметьте разницу, когда я наполняю пузыри водородом. (Тут лектор стал надувать мыльные пузыри водородом, и они унеслась под потолок зала.) Видите, это вам показывает, до чего легок водород, раз он уносит с собой не только обыкновенный мыльный пузырь, но и свисающую с него каплю. Можно еще убедительнее доказать легкость водорода - он способен поднимать пузыри куда крупнее этих: ведь в прежние времена водородом наполняли даже воздушные шары. Мистер Андерсон сейчас присоединит эту трубку к нашему источнику водорода, и у нас тут пойдет струя водорода, так что мы сможем надуть вот этот коллодиевый шар. Мне даже не приходится предварительно удалять из него весь воздух: я ведь знаю, что водород и так сможет унести его вверх. (Тут были надуты и взлетели два шара: один - свободный, другой - на привязи) Вот и еще один, покрупнее, из тонкой пленки; мы его наполним и предоставим ему возможность подняться. Вы увидите, что все шары будут продолжать держаться наверху, пока газ из них не улетучится. Каково же соотношение масс этих веществ - воды и водорода? Взгляните на таблицу. В качестве мер емкости я здесь взял пинту и кубический фут и против них проставил соответствующие цифры. Одна пинта водорода имеет массу 3/4 грана - нашей мельчайшей единицы массы, а кубический фут его имеет массу 1/12 унции, тогда как пинта воды имеет массу 8750 гран, а кубический фут воды имеет массу почти тысячу унций. Таким образом, вы видите, сколь колоссальна разница между массой кубического фута воды и водорода.[ 24 ] Ни в процессе своего горения, ни потом в качестве продукта сгорания водород не дает никакого вещества, которое может стать твердым. Сгорая, он дает только воду. Холодный стакан над пламенем водорода запотевает, и немедленно выделяется заметное количество воды. При горении водорода не возникает ничего, кроме такой же самой воды, как та, которая на ваших глазах была получена из пламени свечи. Запомните важное обстоятельство: водород - это единственное вещество в природе, дающее при сгорании только воду. А теперь нам надо постараться найти еще добавочное доказательство того, что собой представляет вода, и ради этого я немного задержу вас, чтобы на следующую лекцию вы пришли более подготовленными к нашей теме. Мы можем так расположить цинк, - который, как вы убедились, действует на воду с помощью кислоты, - чтобы вся энергия получилась там, где она нам нужна. За моей спиной стоит вольтов столб, и в конце сегодняшней лекции я покажу вам, на что он способен, чтобы вы знали, с чем мы будем иметь дело в следующий раз. Вот у меня в руках концы проводов, передающих ток от батареи; я их заставлю действовать на воду. Мы уже убедились, какой силой сгорания обладают калий, цинк и железные опилки, но ни одно из этих веществ не проявляет такой энергии, как вот это. (Тут лектор соединяет концы проводов, идущих от электрической батареи, и получается яркая вспышка.) Этот свет получается благодаря реакции целых сорока цинковых кружочков, из которых состоит батарея. Это - энергия, которую я по желанию могу держать в руках с помощью этих проводов, хотя она погубила бы меня в один миг, если бы я, по недосмотру, приложил эту энергию к самому себе: ведь она отличается чрезвычайной интенсивностью, и количество энергии, которая здесь выделяется, пока вы успеете досчитать до пяти (лектор снова соединяет полюса и показывает электрический разряд), так велико, что оно равняется энергии нескольких гроз, вместе взятых. А для того, чтобы вы могли убедиться в интенсивности этой энергии, я присоединю концы проводов, передающих энергию от батареи, к стальному напильнику, и, пожалуй, мне удастся таким образом сжечь напильник. Источником этой энергии является химическая реакция. Следующий раз я приложу эту энергию к воде и покажу вам, какие результаты у нас получатся. Примечания:1 1 фунт = 453,6 г. - прим. ред. 2 искры, возникающие при стачивании наждачного круга, дают достаточно много света; вместе с тем они не воспламеняют рудничный газ из-за их сравнительной невысокой температуры. - прим. ред. 17 Имеется в виду кочерга с массивной металлической ручкой. - Прим. ред. 18 Протей - в греческой мифологии морское божество, вещий старец. Ему приписывалась удивительная способность принимать различные образы и мгновенно исчезать. - Прим. ред. 19 Лекции Фарадея читались в период зимних каникул. Видимо, чередовались заморозки и оттепели, которые приводили к затоплению подвальных помещений. - Прим. ред. 20 Наибольшую плотность вода имеет при 39,1 градуса по шкале Фаренгейта. - Прим. В. Крукса В шкале Фаренгейта температурный интервал между точкой таяния льда и точкой кипения воды разделен на 180 градусов, причем точке таяния льда приписана температура +32°. Легко сосчитать, что приведенное в примечании к английскому изданию значение температуры соответствует четырем градусам по шкале Цельсия. - Прим. ред 21 В смеси с солью температура таяния льда понижается. - Прим. ред. 22 В футе двенадцать дюймов. 1 фут равен 30,4 см. - Прим. ред. 23 Калий, металлическая основа поташа, был открыт в 1807 г. Гэмфри Дэви, которому удалось выделить его из поташа при помощи вольтовой батареи. Из-за сильного сродства к кислороду калий разлагает воду с выделением водорода, который воспламеняется и горит с выделением тепла. - Прим. В. Крукса 24 1 пинта = 0.568 литра, 1 гран = 0,0648 г, 1 унция = 28.3 г. - Прим. ред. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Другие сайты | Наверх |
||||
|
|
||||